Kanser kolorektal nonpolyposis keturunan (HNPCC), juga dipanggil Sindrom Lynch, adalah keadaan genetik dominan autosomal yang dikaitkan dengan risiko tinggi terjadinya barah usus besar dan juga barah lain termasuk barah endometrium (kedua paling umum), ovari, perut, usus kecil, saluran hepatobiliari, saluran kencing atas, otak, dan kulit. Peningkatan risiko untuk barah ini disebabkan oleh mutasi yang diwarisi yang merosakkan ketidakcocokan DNA. Ia adalah sejenis sindrom barah.
Gejala sindrom Lynch
Risiko barah
Risiko seumur hidup dan usia rata-rata semasa diagnosis untuk kanser yang berkaitan dengan sindrom Lynch
| Jenis barah | Risiko seumur hidup (%) | Umur rata-rata semasa diagnosis (tahun) |
| Kolorektal | 52-58 | 44-61 |
| Endometrial | 25-60 | 48-62 |
| Gastrik | 6-13 | 56 |
| Ovari | 4-12 | 42.5 |
Selain jenis barah yang terdapat dalam carta di atas, difahami bahawa sindrom Lynch juga menyumbang kepada peningkatan risiko barah usus kecil, barah pankreas, barah pelvis ureter / ginjal, barah saluran empedu, barah otak, dan neoplasma sebaceous. Peningkatan risiko barah prostat dan barah payudara juga dikaitkan dengan sindrom Lynch, walaupun hubungan ini tidak sepenuhnya difahami.
Dua pertiga daripada barah usus besar berlaku di usus besar proksimal dan tanda dan gejala yang biasa termasuk darah di dalam najis, cirit-birit atau sembelit, dan penurunan berat badan yang tidak diingini. Umur rata-rata diagnosis kanser kolorektal adalah 44 untuk ahli keluarga yang memenuhi kriteria Amsterdam. Purata usia diagnosis kanser endometrium adalah sekitar 46 tahun. Di antara wanita dengan HNPCC yang mempunyai barah usus besar dan endometrium, kira-kira separuh hadir pertama dengan barah endometrium, menjadikan kanser endometrium sebagai barah sentinel yang paling biasa dalam sindrom Lynch. Gejala barah endometrium yang paling biasa adalah pendarahan faraj yang tidak normal. Di HNPCC, usia rata-rata diagnosis kanser gastrik adalah 56 tahun dengan adenokarsinoma jenis usus menjadi patologi yang paling kerap dilaporkan. Kanser ovari yang berkaitan dengan HNPCC mempunyai usia diagnosis purata 42.5 tahun; kira-kira 30% didiagnosis sebelum usia 40 tahun.
Variasi yang ketara dalam kadar kanser telah dijumpai bergantung pada mutasi yang terlibat. Hingga usia 75 tahun, risiko kanser kolorektal, barah endometrium, barah ovari, gastrointestinal atas (gastrik, duodenum, saluran empedu atau pankreas), barah saluran kencing, barah prostat dan tumor otak adalah seperti berikut: untuk mutasi MLH1 risikonya masing-masing adalah 46%, 43%, 10%, 21%, 8%, 17% dan 1%; untuk mutasi MSH2 risiko masing-masing adalah 57%, 17%, 10%, 25%, 32%, dan 5%; untuk mutasi MSH6 risiko masing-masing adalah 15%, 46%, 13%, 7%, 11%, 18% dan 1%.
| Gen | Risiko barah ovari | Risiko barah endometrium |
|---|---|---|
| MLH1 | 4-24% | 25-60% |
| MSH2 / EPCAM | 4-24% | 25-60% |
| MSH6 | 1-11% | 16-26% |
| PMS2 | 6% (risiko gabungan) | 15% |
Genetik

HNPCC diwarisi secara autosomal dominan. Ciri utama HNPCC adalah pembaikan ketidakcocokan DNA yang rosak, yang menyebabkan peningkatan kadar perubahan nukleotida tunggal dan ketidakstabilan mikrosatelit, juga dikenal sebagai MSI-H (H adalah “tinggi”). MSI dikenal pasti dalam spesimen barah di makmal patologi. Sebilangan besar kes mengakibatkan perubahan panjang ulangan dinucleotide sitokin nukleobase dan adenin (urutan: CACACACACA…).
4 gen utama yang terlibat dalam HNPCC biasanya menyandikan protein yang membentuk dimer untuk berfungsi:
- Protein MLH1 dimeriminasi dengan protein PMS2 untuk membentuk MutLα, yang mengkoordinasikan pengikatan protein lain yang terlibat dengan pembaikan ketidakcocokan seperti helikase DNA, protein pengikat DNA tunggal-untai (RPA), dan polimerase DNA.
- Protein MSH2 dimeriminasi dengan protein MSH6, yang mengenal pasti ketidakcocokan melalui model penjepit gelongsor, protein untuk mengimbas kesalahan.
Kerosakan kedua-dua gen untuk dimer protein merosakkan fungsi protein. 4 gen ini terlibat dalam pembetulan ralat (ketidakcocokan pembaikan), jadi disfungsi gen dapat menyebabkan ketidakupayaan memperbaiki kesalahan replikasi DNA dan menyebabkan HNPCC. HNPCC diketahui berkaitan dengan mutasi lain dalam gen yang terlibat dalam jalan pembaikan ketidakcocokan DNA:
| Nama OMIM | Gen yang terlibat dalam HNPCC | Kekerapan mutasi dalam keluarga HNPCC | Lokus | Penerbitan pertama |
|---|---|---|---|---|
| HNPCC1 (120435) | MSH2 / EPCAM | lebih kurang 60% | 2p22 | Fishel 1993 |
| HNPCC2 (609310) | MLH1 | lebih kurang 30% | 3p21 | Papadopoulos 1994 |
| HNPCC5 | MSH6 | 7-10% | 2p16 | Miyaki 1997 |
| HNPCC4 | PMS2 | agak jarang | 7p22 | Nicolaides 1994 |
| HNPCC3 | PMS1 | laporan kes | 2q31-q33 | Nicolaides 1994 |
| HNPCC6 | TGFBR2 | laporan kes | 3p22 | |
| HNPCC7 | MLH3 | dipertikaikan | 14q24.3 |
Sebilangan besar orang dengan HNPCC mewarisi syarat tersebut daripada ibu bapa. Namun, kerana penembusan yang tidak lengkap, usia diagnosis kanser yang berubah-ubah, pengurangan risiko kanser, atau kematian awal, tidak semua orang dengan mutasi gen HNPCC memiliki orang tua yang menderita barah. Sebilangan orang mengembangkan HNPCC de-novo dalam generasi baru, tanpa mewarisi gen. Orang-orang ini sering hanya dikenal pasti setelah menghidap barah usus awal. Ibu bapa dengan HNPCC mempunyai peluang 50% untuk menyampaikan mutasi genetik kepada setiap anak. Penting juga untuk diperhatikan, bahawa mutasi yang merosakkan pada salah satu gen MMR saja tidak mencukupi untuk menyebabkan barah, tetapi mutasi lebih lanjut pada gen penekan tumor lain perlu berlaku.
Diagnosis sindrom Lynch
Diagnosis sindrom Lynch diterapkan pada orang dengan mutasi DNA kuman pada salah satu gen MMR (MLH1, MSH2, MSH6, dan PMS2) atau gen EPCAM, yang diidentifikasi oleh ujian genetik. Calon untuk ujian genetik kuman dapat dikenal pasti dengan kriteria klinikal seperti Kriteria Klinikal Amsterdam dan Petunjuk Bethesda, atau melalui analisis tumor dengan imunohistokimia (IHC), atau ujian ketidakstabilan mikrosatelit (MSI). Di AS, masyarakat profesional mengesyorkan menguji setiap barah usus besar untuk MSI atau IHC sebagai pemeriksaan sindrom Lynch, tetapi ini tidak selalu dilakukan kerana keterbatasan kos dan sumber daya. Ujian genetik tersedia secara komersial dan terdiri daripada ujian darah.
Imunohistokimia
Immunohistochemistry (IHC) adalah kaedah yang boleh digunakan untuk mengesan ekspresi protein abnormal mismatch Repair (MMR) pada tumor yang berkaitan dengan sindrom Lynch. Walaupun tidak mendiagnosis sindrom Lynch, ia dapat memainkan peranan dalam mengenal pasti orang yang seharusnya menjalani ujian garis kuman. Dua kaedah pelaksanaan ujian IHC merangkumi ujian berdasarkan usia dan ujian universal untuk semua orang. Saat ini, tidak ada kesepakatan luas mengenai metode penyaringan mana yang harus digunakan. Ujian berdasarkan usia untuk IHC telah disarankan sebahagiannya kerana analisis kos-manfaat, sedangkan ujian universal untuk semua orang dengan barah kolorektal memastikan orang dengan sindrom Lynch tidak ketinggalan. Untuk menangani kosnya, para penyelidik berusaha untuk meramalkan MSI atau IHC secara langsung dari cara tumor kelihatan di bawah mikroskop, tanpa melakukan ujian molekul.
Ketidakstabilan satelit
Mutasi dalam sistem pembaikan ketidakcocokan DNA dapat menyebabkan kesukaran menghantar kawasan di dalam DNA yang mengandungi corak berulang dua atau tiga nukleotida (mikrosatelit), atau dikenal sebagai ketidakstabilan mikrosatelit (MSI). MSI dikenal pasti melalui pengekstrakan DNA dari kedua-dua sampel tisu tumor dan sampel tisu normal diikuti dengan analisis PCR kawasan mikrosatelit. Analisis MSI boleh digunakan untuk mengenal pasti orang yang mungkin mempunyai sindrom Lynch dan mengarahkan mereka untuk ujian lebih lanjut.
Pengelasan
Tiga kumpulan utama kanser MSI-H (ketidakstabilan mikrosatelit – MSI) dapat dikenali dengan kriteria histopatologi:
- kanser sebelah kanan yang tidak membezakan
- barah mukosa sebelah kanan
- adenokarsinoma di mana-mana lokasi yang menunjukkan tahap limfosit intraepitelium (TIL) yang dapat diukur
Kriteria histopatologi tidak cukup sensitif untuk mengesan MSI dari histologi tetapi para penyelidik berusaha menggunakan kecerdasan buatan untuk meramalkan MSI dari histologi.
Di samping itu, HNPCC boleh dibahagikan kepada sindrom Lynch I (barah usus besar keluarga) dan sindrom Lynch II (HNPCC yang berkaitan dengan barah saluran gastrointestinal atau sistem pembiakan lain).
Pencegahan
Ujian saringan
Kaunseling genetik dan ujian genetik disyorkan untuk keluarga yang memenuhi kriteria Amsterdam, lebih baik sebelum bermulanya barah usus besar.
Kanser kolon
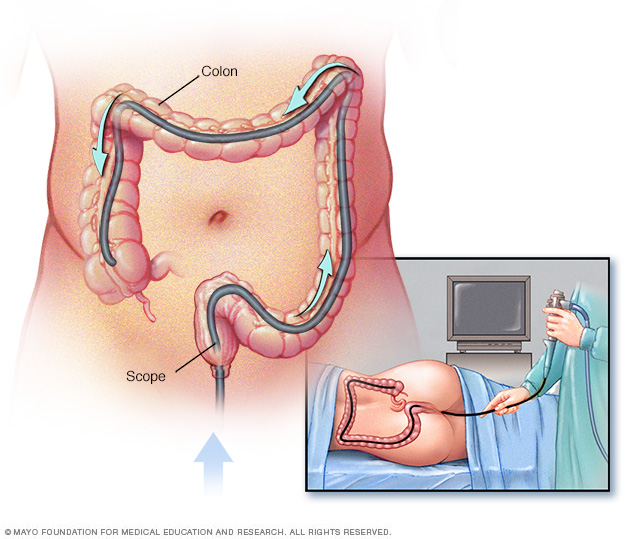
Kolonoskopi disyorkan sebagai kaedah pencegahan pengawasan bagi individu yang mempunyai sindrom Lynch, atau gen yang berkaitan dengan LS. Secara khusus, disarankan agar kolonoskopi bermula pada usia 20–25 untuk pembawa mutasi MLH1 dan MSH2 dan 35 tahun untuk pembawa mutasi MSH6 dan PMS2. Pengawasan kolonoskopi kemudiannya harus dilakukan pada selang 1-2 tahun untuk pesakit sindrom Lynch.
Kanser endometrium / ovari
Ultrasound transvaginal dengan atau tanpa biopsi endometrium disyorkan setiap tahun untuk pemeriksaan kanser ovari dan endometrium. Bagi wanita dengan sindrom Lynch, ujian darah CA-125 setiap tahun boleh digunakan untuk memeriksa kanser ovari, namun terdapat data yang terhad mengenai keberkesanan ujian ini dalam mengurangkan kematian.
Kanser lain
Terdapat juga strategi untuk mengesan barah lain lebih awal atau mengurangkan kemungkinan mengidapnya sehingga orang dengan sindrom Lynch dapat berbincang dengan doktor mereka, namun keberkesanannya tidak jelas. Pilihan ini merangkumi:
- Endoskopi atas untuk mengesan barah perut dan usus kecil setiap 3-5 tahun, bermula pada usia 30 tahun paling awal (sebaiknya dalam kajian)
- Urinalisis tahunan untuk mengesan barah pundi kencing, bermula pada usia 30 tahun paling awal (lebih baik dalam kajian)
- Pemeriksaan fizikal dan neurologi tahunan untuk mengesan barah di sistem saraf pusat (otak atau saraf tunjang), bermula pada usia 25 tahun paling awal
Kriteria Amsterdam
Berikut adalah kriteria Amsterdam dalam mengenal pasti calon berisiko tinggi untuk ujian genetik molekul:
Kriteria Amsterdam I (semua butir mesti dipenuhi):
- Tiga atau lebih ahli keluarga dengan diagnosis kanser kolorektal yang disahkan, salah satunya adalah saudara ijazah pertama (ibu bapa, anak, saudara kandung) dari dua yang lain
- Dua generasi terjejas berturut-turut
- Satu atau lebih barah usus yang didiagnosis di bawah umur 50 tahun
- Poliposis adenomatous keluarga (FAP) telah dikecualikan
Kriteria Amsterdam II dikembangkan pada tahun 1999 dan meningkatkan kepekaan diagnostik untuk sindrom Lynch dengan memasukkan barah endometrium, usus kecil, ureter dan pelvis buah pinggang.
Kriteria Amsterdam II (semua butir mesti dipenuhi):
- Tiga atau lebih ahli keluarga dengan barah yang berkaitan dengan HNPCC, salah satunya adalah kerabat peringkat pertama dari dua yang lain
- Dua generasi terjejas berturut-turut
- Satu atau lebih barah yang berkaitan dengan HNPCC didiagnosis di bawah umur 50 tahun
- Poliposis adenomatous keluarga (FAP) telah dikecualikan
Pembedahan
Histerektomi profilaksis dan salpingo-oophorectomy (pembuangan rahim, tiub Fallopian, dan ovari untuk mencegah barah berkembang) dapat dilakukan sebelum barah ovari atau endometrium berkembang.
Rawatan sindrom Lynch
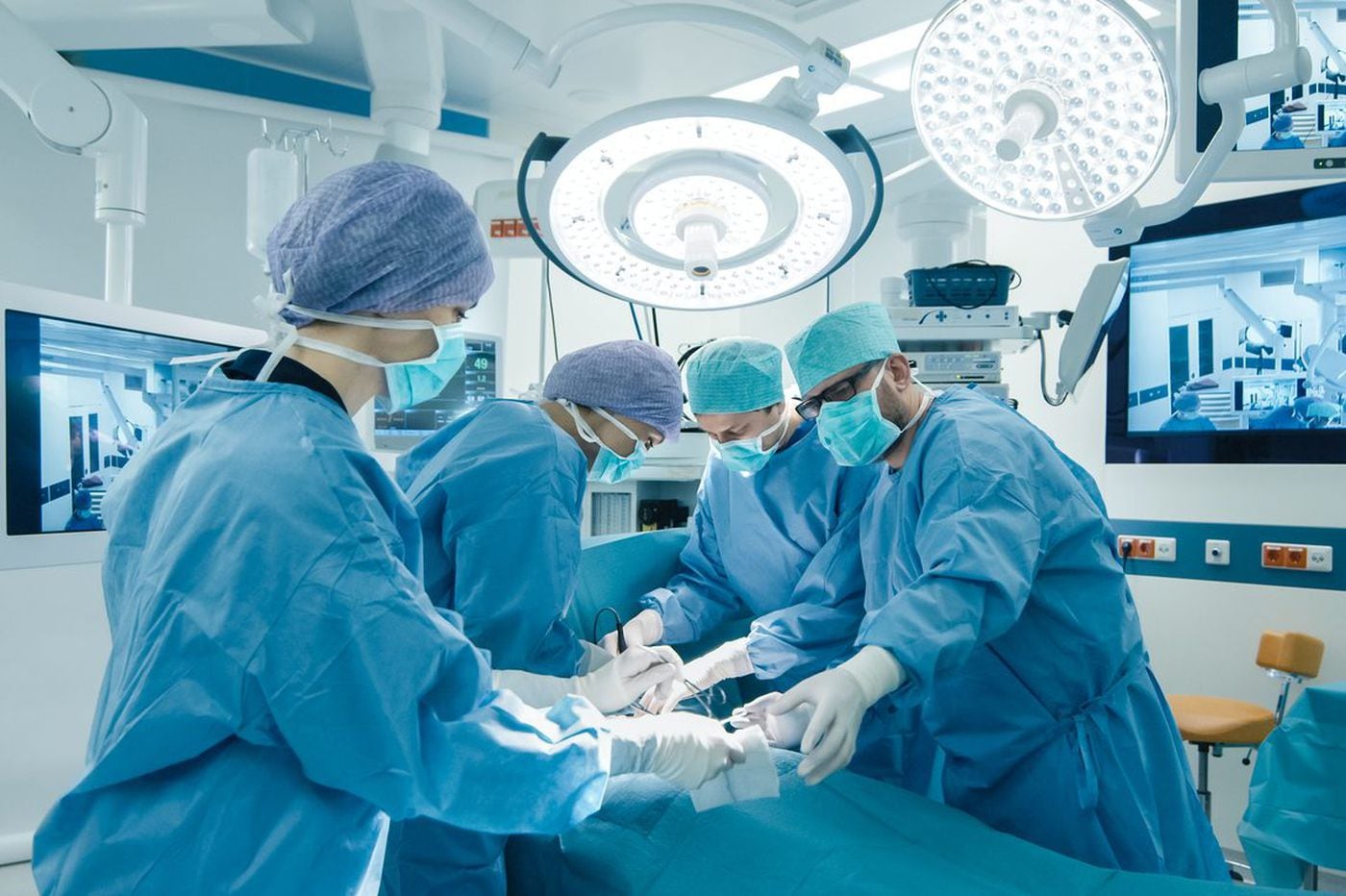
Pembedahan tetap menjadi terapi barisan hadapan untuk HNPCC. Pesakit dengan sindrom Lynch yang menghidap barah kolorektal boleh dirawat dengan kolektomi separa atau kolektomi total dengan anastomosis ileorectal. Oleh kerana peningkatan risiko barah kolorektal berikut kolektomi separa dan kualiti hidup yang serupa setelah kedua-dua pembedahan, kolektomi total mungkin merupakan rawatan pilihan untuk HNPCC, terutama pada pesakit yang lebih muda.
Terdapat kontroversi yang berterusan mengenai manfaat terapi tambahan berasaskan 5-fluorouracil untuk tumor kolorektal yang berkaitan dengan HNPCC, terutama yang berada pada tahap I dan II.
- Terapi antibodi anti-PD-1 boleh berkesan.
Penyekat pusat pemeriksaan dengan terapi anti-PD-1 kini menjadi terapi lini pertama yang disukai untuk Mikrosatelit-Ketidakstabilan yang tinggi –Kanser kolorektal tinggi.
.