| Alpha-amilase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
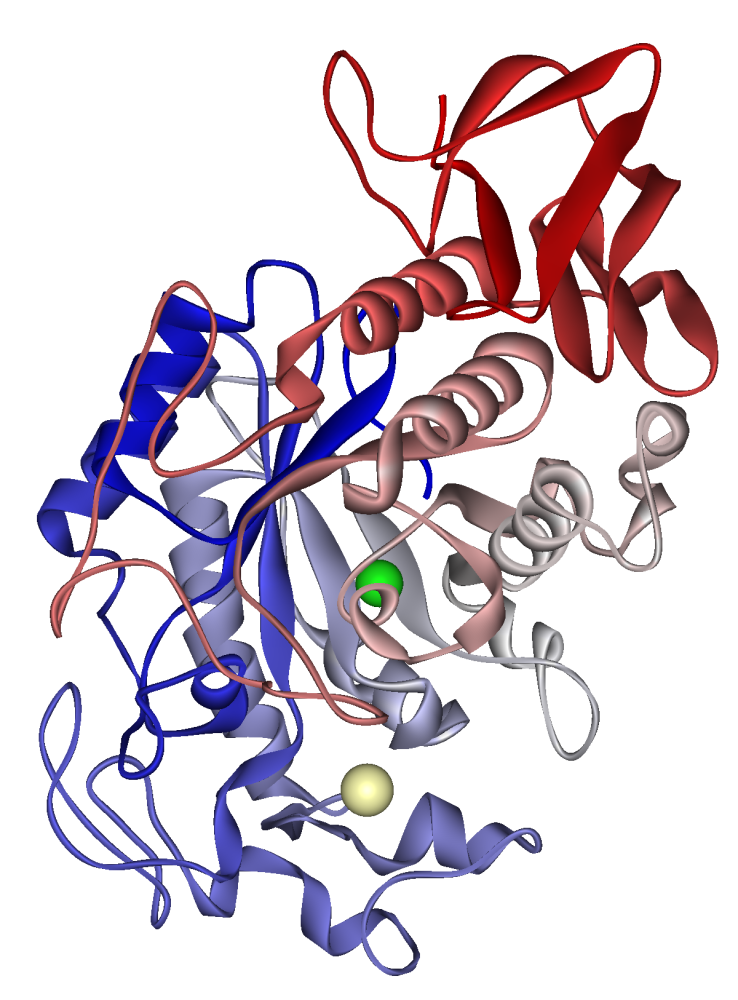
Amilase air liur manusia: ion kalsium kelihatan dalam khaki pucat, ion klorida berwarna hijau. PDB 1SMD
|
|||||||||
| Pengenal | |||||||||
| No. EC | 3.2.1.0 | ||||||||
| No. CAS | 9000-90-2 | ||||||||
| Pangkalan Data | |||||||||
| IntEnz | Paparan IntEnz | ||||||||
| BRENDA | Kemasukan BRENDA | ||||||||
| KECUALI | Pandangan NiceZyme | ||||||||
| KEGG | Kemasukan KEGG | ||||||||
| MetaCyc | laluan metabolik | ||||||||
| PRIAM | profil | ||||||||
| Struktur PDB | RCSB PDB PDBs PDBsum | ||||||||
|
|||||||||
| Domain pemangkin GH13 | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Cyclodextrin glucanotransferase (ec2.4.1.19) (cgtase)
|
|||||||||
| Pengenal | |||||||||
| Simbol | Alpha-amilase | ||||||||
| Pfam | PF00128 | ||||||||
| Puak Pfam | CL0058 | ||||||||
| InterPro | IPR006047 | ||||||||
| SKOP2 | 1ppi / SKOP / SUPFAM | ||||||||
| Keluarga super OPM | 117 | ||||||||
| Protein OPM | 1wza | ||||||||
| CEPAT | GH13 | ||||||||
| CDD | cd11338 | ||||||||
|
|||||||||
| Domain alpha-amylase C-terminal beta-sheet | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Struktur kristal barley alpha-amylase isozyme 1 (amy1) mutan tidak aktif d180a dalam kompleks dengan maltoheptaose
|
|||||||||
| Pengenal | |||||||||
| Simbol | Alpha-amyl_C2 | ||||||||
| Pfam | PF07821 | ||||||||
| InterPro | IPR012850 | ||||||||
|
|||||||||
| Alpha amylase, domain C-terminal semua-beta | |||||||||
|---|---|---|---|---|---|---|---|---|---|
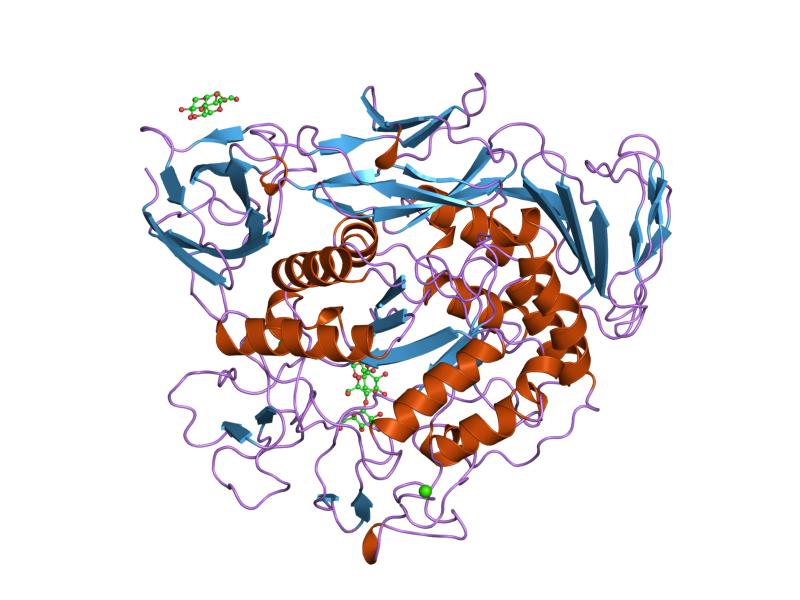
kompleks maltotriose mutan siklodekstrin glikosiltransferase prapondisi
|
|||||||||
| Pengenal | |||||||||
| Simbol | Alpha-amilase_C | ||||||||
| Pfam | PF02806 | ||||||||
| Puak Pfam | CL0369 | ||||||||
| InterPro | IPR006048 | ||||||||
| SKOP2 | 1ppi / SKOP / SUPFAM | ||||||||
|
|||||||||
Alpha-amilase, (α-amilase) adalah enzim EC 3.2.1.1 yang menghidrolisis ikatan alfa polisakarida alfa yang besar, seperti kanji dan glikogen, menghasilkan rantai pendeknya, dekstrin, dan maltosa. Ia adalah bentuk amilase utama yang terdapat pada manusia dan mamalia lain. Ini juga terdapat dalam biji yang mengandung kanji sebagai cadangan makanan, dan disembunyikan oleh banyak jamur. Ia adalah ahli keluarga glikosida hidrolase 13.
Dalam biologi manusia
Walaupun terdapat dalam banyak tisu, amilase paling menonjol dalam jus pankreas dan air liur, masing-masing mempunyai isoform α-amilase manusia sendiri. Mereka berperilaku berbeza pada pemfokusan isoelektrik, dan juga dapat dipisahkan dalam pengujian dengan menggunakan antibodi monoklonal tertentu. Pada manusia, semua isoform amilase menghubungkan ke kromosom 1p21 (lihat AMY1A).
Amilase air liur (ptyalin)
Amilase terdapat dalam air liur dan memecah kanji menjadi maltosa dan dekstrin. Bentuk amilase ini juga disebut “ptyalin” /ˈtaɪəlɪn/, yang dinamakan oleh ahli kimia Sweden Jöns Jacob Berzelius. Nama itu berasal dari kata Yunani πτυω (I spit), kerana zat itu diperoleh dari air liur. Ia akan memecahkan molekul pati yang tidak larut menjadi kanji larut (amilodextrin, eritrodextrin, dan achrodextrin) menghasilkan pati yang berturut-turut lebih kecil dan akhirnya maltosa. Ptyalin bertindak pada hubungan glikosidik α (1,4) linear, tetapi hidrolisis kompaun memerlukan enzim yang bertindak pada produk bercabang. Amilase air liur tidak aktif di dalam perut oleh asid gastrik. Dalam jus gastrik yang disesuaikan dengan pH 3.3, ptyalin dinyahaktifkan sepenuhnya dalam 20 minit pada suhu 37 ° C. Sebaliknya, 50% aktiviti amilase kekal setelah 150 minit terdedah kepada jus gastrik pada pH 4.3. Kedua-dua kanji, substrat untuk ptyalin, dan produk (rantai glukosa pendek) dapat melindungi sebahagiannya daripada ketidakaktifan oleh asid gastrik. Ptyalin yang ditambahkan pada buffer pada pH 3.0 mengalami ketidakaktifan lengkap dalam 120 minit; namun, penambahan pati pada tahap 0.1% mengakibatkan 10% aktiviti yang tinggal, dan penambahan pati yang serupa ke tahap 1.0% menghasilkan sekitar 40% aktiviti yang tinggal pada 120 minit.
Keadaan optimum untuk ptyalin
- PH optimum – 7.0
- Suhu badan manusia
- Kehadiran anion dan penggerak tertentu:
- Klorida dan bromida – paling berkesan
- Iodida – kurang berkesan
- Sulfat dan fosfat – paling tidak berkesan
Variasi genetik pada amilase air liur manusia
Gen amilase air liur telah mengalami penduaan semasa evolusi, dan kajian hibridisasi DNA menunjukkan banyak individu mempunyai berulang berulang gen tersebut. Bilangan salinan gen berkorelasi dengan tahap amilase air liur, seperti yang diukur dengan analisis protein blot menggunakan antibodi terhadap amilase manusia. Nombor salinan gen dikaitkan dengan pendedahan evolusi yang jelas terhadap diet berkanji tinggi. Sebagai contoh, seorang individu Jepun mempunyai 14 salinan gen amilase (satu alel dengan 10 salinan, dan alel kedua dengan empat salinan). Makanan Jepun secara tradisional mengandungi sejumlah besar pati beras. Sebaliknya, seorang individu Biaka membawa enam salinan (tiga salinan pada setiap alel). Biaka adalah pengumpul-pemburu hutan hujan yang secara tradisinya memakan makanan rendah pati. Perry dan rakan-rakannya berspekulasi peningkatan jumlah salinan gen amilase air liur mungkin meningkatkan kelangsungan hidup bertepatan dengan peralihan ke diet berkanji semasa evolusi manusia.
Amilase pankreas
P-pankreas α-amilase secara rawak menghilangkan kaitan glikosidik α (1-4) amilosa untuk menghasilkan dextrin, maltosa, atau maltotriose. Ia menggunakan mekanisme perpindahan berganda dengan pengekalan konfigurasi anomerik. Pada manusia, amilase air liur berkembang dari salinannya.
Dalam patologi
Ujian amilase lebih mudah dilakukan daripada lipase, menjadikannya ujian utama yang digunakan untuk mengesan dan memantau pankreatitis. Makmal perubatan biasanya mengukur sama ada amilase pankreas atau amilase total. Sekiranya hanya amilase pankreas yang diukur, peningkatan tidak akan dapat dilihat dengan penyakit gondok atau trauma kelenjar air liur yang lain.
Namun, kerana jumlah yang ada sedikit, masa sangat penting ketika mengambil sampel darah untuk pengukuran ini. Darah harus diambil segera setelah sakit pankreatitis, jika tidak, ia dikeluarkan dengan cepat oleh buah pinggang.
Α-amilase air liur telah digunakan sebagai biomarker untuk tekanan dan sebagai penanda aktiviti aktiviti sistem saraf simpatik (SNS) yang tidak memerlukan pengambilan darah.
Tafsiran
Peningkatan tahap plasma pada manusia terdapat pada:
- Trauma air liur (termasuk intubasi anestetik)
- Gondok – kerana keradangan kelenjar air liur
- Pankreatitis – kerana kerosakan pada sel yang menghasilkan amilase
- Kegagalan buah pinggang – kerana perkumuhan berkurang
Jumlah bacaan amilase lebih dari 10 kali had atas normal (ULN) menunjukkan pankreatitis. Lima hingga 10 kali ULN mungkin menunjukkan penyakit ileus atau duodenal atau kegagalan buah pinggang, dan peningkatan yang lebih rendah biasanya terdapat pada penyakit kelenjar air liur.
Gen
- air liur – AMY1A, AMY1B, AMY1C
- pankreas – AMY2A, AMY2B
Dalam bijirin
Kegiatan α-Amilase dalam biji-bijian diukur dengan, misalnya, Hagberg – Perten Falling Number, ujian untuk menilai kerusakan tunas, atau kaedah Phadebas. Berlaku dalam gandum.
Penggunaan industri
α-Amilase digunakan dalam pengeluaran etanol untuk memecahkan pati dalam biji-bijian menjadi gula yang dapat ditapai.
Langkah pertama dalam pengeluaran sirap jagung fruktosa tinggi adalah rawatan pati jagung dengan α-amilase, menghasilkan rantai oligosakarida gula yang lebih pendek.
Α-amilase yang disebut “Termamyl”, bersumber dari Bacillus licheniformis, juga digunakan dalam beberapa detergen, terutama pencuci pinggan dan pencuci yang menghilangkan kanji.
Lihat amilase untuk lebih banyak penggunaan keluarga amilase secara amnya.
Berpotensi untuk penggunaan perubatan
α-Amilase telah menunjukkan keberkesanan dalam menurunkan biofilm bakteria polimikrob dengan menghidrolisis hubungan glikosid α (1-4) dalam struktur, eksopolisakarida matriks bahan polimer ekstraselular (EPS).
Perencatan penampan
Molekul tris dilaporkan menghalang sejumlah α-amilase bakteria, sehingga tidak boleh digunakan dalam penyangga tris.
Keazaman
Terdapat beberapa kaedah untuk menentukan aktiviti α-amilase, dan industri yang berlainan cenderung bergantung pada kaedah yang berbeza. Uji iodin kanji, pengembangan ujian yodium, didasarkan pada perubahan warna, kerana α-amilase menurunkan pati dan biasanya digunakan dalam banyak aplikasi. Ujian yang serupa tetapi dihasilkan secara industri adalah ujian amilase Phadebas, yang digunakan sebagai ujian kualitatif dan kuantitatif dalam banyak industri, seperti detergen, pelbagai tepung, biji-bijian, dan makanan malt, dan biologi forensik.
Senibina domain
α-Amilase mengandungi sebilangan domain protein yang berbeza. Domain pemangkin mempunyai struktur yang terdiri daripada laras alfa / beta delapan helai yang mengandungi laman aktif, terganggu oleh domain pengikat kalsium ~ 70-asid amino yang menonjol antara helai beta 3 dan heliks alpha 3, dan Greek karboksil domain beta-tong utama. Beberapa alpha-amylases mengandungi domain beta-sheet, biasanya di terminal C. Domain ini disusun sebagai helaian beta antiparallel lima helai. Beberapa alpha-amylases mengandungi domain all-beta, biasanya di terminal C.
.
















